대한 상기도 바이러스 감염 연구회
1차 학술대회를 다녀와서
 0
리앤홍이비인후과 이현종
0
리앤홍이비인후과 이현종

2022년을 맞이하여 이비인후과학회에서는 드디어 임상적인 바이러스질환에 대한 관심을 보이기 시작했고, 그 결과 상기도바이러스감염연구회가 탄생하게 되었다.
그 새로운 시작을 같이 해본 입장에서 생생한 현장을 전달하고자 제1회 학술대회 내용을 요약해서 동료들에게 보고하려 한다. 많은 개원의들과 현장에서 활발히 활동하는 임상의들에게 조그만 도움이 되었길 바라면서.
개인적으로 이번 학회를 참석하게 되었을 때 코로나-19 관련해서 궁금했던 점은 아래와 같았다.
- 1) 타 바이러스랑 구분되는 특징적인 스파이크 단백질
- 2) 신속항원검사, PCR 등 검사할 때 검출되는 구조는 무엇인지?
- 3) 백신을 만들 때 코로나바이러스 어떤 부분을 타겟으로 만드는지?
- 4) 4차 백신을 꼭 맞아야 하는지? /최근 3년동안 인플루엔자가 유행하지 않았는데, 2022년 절기 인플루엔자 백신은 과연 의미가 있을런지?
- 5) 항바이러스제는 코로나바이러스 어떤 부분과 과정에 작용해서 효과를 나타내는지?
- 6) 롱코비드 등 코로나 관련 후유증은 왜 나타나는지?
그래서, 학회를 참석하면서 내가 가진 궁금증들을 하나씩 풀어보기로 했다.
1. 코로나-19 바이러스 특징 - 스파이크 단백질
바이러스 입자는 유전정보를 갖는 핵산과 이 핵산을 에워싸는 단백질 껍데기(shell)로 구성되는데 핵산은 DNA 또는 RNA로 구성되며 단백질 껍데기는 캡시드(capsid)라고 하며 이는 생화학적 손상으로부터 유전물질을 보호하는 역할을 한다. 바이러스 중에서는 캡시드 외부로 외피(envelope)를 가지는 종류가 있으며 이는 대표적으로 COVID-19 바이러스가 있겠다. 외피는 2중막으로 구성되어 있으며, 이 막에 바이러스가 형성한 당단백질의 구조체 말단이 끼어들어가고, 다른 부분의 말단은 외부로 돌출되어 있어 스파이크(spike)라고 불린다. 이러한 바이러스 외피는 세포의 수용체(receptor)를 인지하여 결합하는 역할을 하며, 중화항체 생성의 타겟이 되기도 한다.
COVID-19 바이러스의 경우 외피의 스파이크 단백질이 인체의 ACE2 (Angiotensin-converting enzyme 2)와 결합하여 스파이크를 기도 상피세포에 붙이거나 끼워넣고 자신의 RNA를 숙주세포 내로 유입하는 역할을 하게 되며 이를 통해 강력한 감염전파력을 가지게 된다. 외피의 구성성분 중 숙주세포로부터 유래하는 지질이중막과는 다르게 스파이크 단백질은 바이러스 고유의 유전물질로부터 형성되기 때문에 생체 면역세포나 진단 또는 치료항체의 타겟이 되기도 한다.
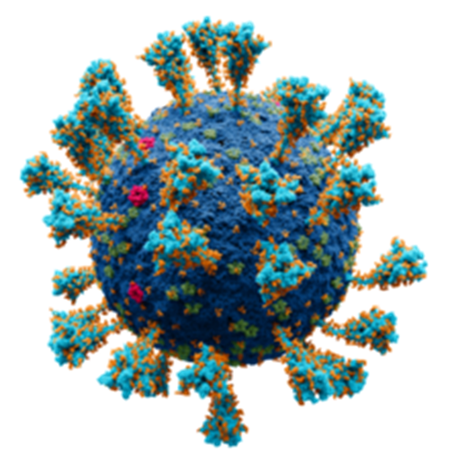
그림 1. 코로나-19 바이러스의 구조 (출저: Wikipedia)
2-1. PCR 검사는 어떤 원리로 진행되는가?
일단 SARS-CoV-2 PCR 키트에서 주로 검출하는 부분은 모든 베타코로나바이러스에서 검출되는 E 유전자이다. 보통 E 유전자는 최종적으로 외피 단백질을 만들게 되는데 이게 바로 왕관 모양의 코로나 형태의 외피를 구성하게 된다(그림 1).
WHO에서 코로나 발생 초기에 확진 검사 목적으로 권고했던 RdRp 유전자는 대표적인 SARS-CoV-2 특이 유전자인데, 기본적인 역할은 바이러스 RNA를 복제하는 효소를 만들어내는 유전자이다. RdRp 유전자 부위를 포함하는 좀더 넓은 범위의 유전자를 ORF1ab 유전자라고 하며, 대부분 PCR 시약제품에서 RdRp 혹은 ORF1ab 이 두가지를 포함시키고 있으며 SARS-CoV-2에 특이적인 RdRp 염기서열만 증폭하도록 제작되었다.
SARS-CoV-2에 특이적인 N 유전자도 몇몇 시약에서 포함하는데, N 유전자가 만들어내는 뉴클레오캡시드 단백질(nucleocapsid protein)은 RNA 게놈에 결합하여 복합체인 뉴클레오캡시드를 형성한다(그림 2).

그림 2. Schematic genome structure and major structure proteins of severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2). *SARS-CoV-2 PCR target genes.
2-2. PCR 결과를 해석하는 방법?
구형 표면에 박혀 있는 곤봉형태의 스파이크 단백질(spike protein)은 S 유전자에서 만들어지며, 그 외 membrane (M) 유전자나 ORF1a, ORF1b 유전자에서도 SARS-CoV-2 특이적인 염기서열을 증폭하도록 제작된 제품들이 있다. SARS-CoV-2 PCR 검사시약 제작 시 SARS-CoV-2에 특이적인 염기서열과 해당 유전자를 검출하도록 primer를 만들어 제작했기 때문에 다른 호흡기바이러스나 감기를 주로 일으키는 human coronavirus 229E 혹은 OC43에 감염된 환자에서 검사해도 검사결과는 음성으로 나오게 된다.
CDC 기준에 따르면 SARS-CoV-2 PCR 키트는 최소 두 개의 유전자를 포함하고 있어야 하며, 양성 음성 판정 시에는 표적 유전자에서 기준으로 정한 Ct 값을 토대로 판정한다. E, RdRp, N과 같은 표적 유전자 두 개 혹은 세 개 유전자가 양성 기준으로 정한 Ct 값 이하로 동시에 검출되면, 양성으로 판정하고, 둘 다 증폭되지 않으면 음성으로 판정하게 된다. 예를 들면 E 유전자 Ct 값 36 이하, RdRp 유전자 Ct 값 36 이하를 기준으로 제작한 PCR 검사 키트를 사용하여 검사했는데 E 와 RdRp 둘 다 Ct 값 20~30 정도로 결과가 나온 경우 SARS-CoV-2 PCR 결과 양성으로 보고 할 수 있다. 만약, 한 개라도 Ct값이 30~40 사이에 있게 된다면 재검이 나오게 되고, Ct값이 50 이상이라면 음성으로 보고하게 된다.
2-3. 신속항원검사는 PCR과 검출되는 부분이 다른가?
PCR 검사법은 세포내부에 존재하는 바이러스 핵산인 RNA를 직접 추출하여 증폭하는 방식으로 감염여부를 확인하는 방식이다. 반면에 항원 검사는 바이러스 RNA를 탐지하는 방식이 아닌, 바이러스를 구성하는 특정 단백질인 뉴클레오캡시드 항원(nucleocapsid antigen)을 검출하는 방식이다.
3. 백신을 만들 때 코로나바이러스 어떤 부분을 타겟으로 만드는지?
코로나 바이러스는 가시 같은 S (스파이크) 단백질이 표면에 있는데, 인간세포에 침투할 때 사용된다. 이런 S 단백질이 감염시킬 때 매우 중요한 역할을 하므로 백신 개발은 S 단백질을 표적으로 한다. 화이자 백신은 S 단백질을 만들 수 있는 유전코드 mRNA를 사용하는데, mRNA는 안정적이지 않고 잘 분해되기 때문에 지방(Lipid) 나노입자로 만든 지방성 거품으로 포장한다.
접종 후 백신입자들이 세포에 결합해서 mRNA를 세포 안에 넣으면, 세포는 mRNA의 코드에 따라 S 단백질을 만들어내고, 백신의 mRNA는 S단백질을 만든 후 세포내에서 파괴된다. 이후 백신이 들어간 세포가 분해될 때, 많은 세포 조각들이 S 단백질을 포함해서 나오게 된다.
이 조각 단백질들이 항원제시 세포(Antigen-presenting cell)에 흡수되고, 이 세포는 다시 S 단백질조각들을 세포 표면에 만드는데, 다른 종류의 도우미 면역세포(Helper T cell)가 이 조각 단백질을 인식하면서 다른 면역세포를 도와 코로나 감염과 싸우게 된다.
이때, 다른 B세포라고 불리는 면역세포가 Helper T 세포에 의하여 활성화되면, 세포증식을 시작하면서 많은 양의 S 단백질을 표적으로 하는 항체를 만들어 낸다.
4-1. 코로나 4차 백신의 효과는?
이스라엘의 전국적인 대량 백신접종 데이터를 사용하여 수행된 이 대규모(약 70만명) 관찰 연구에서 보면 BNT162b2 mRNA COVID-19 백신의 세 번째 접종이 심각한 COVID-19 관련 사건/사고를 예방하는 데 효과적이라고 추정하고 있다. 최소 5개월 전에 2회 접종한 것과 비교하여 3회 접종 시, 세 번째 접종 후 7일 이상 지났을 때 코로나19 관련 입원 예방 93%, 중증 질환 예방 92%, 코로나 19 관련 사망 예방은 81% 정도로 추산된다.
60세 이상 연령층 4차접종 실시: 2022-6월 질병청 브리핑
- 코로나19 예방접종 대응추진단(단장 백경란 청장, 이하 ‘추진단’)은 60세 이상 연령층에 대한 4차접종의 중요성을 강조하였다.
- 최근 4주간(22.5.8.∼6.4.) 위중증 환자의 87%, 사망자의 90%가 60세 이상 연령층에 집중되어 있고, 특히 사망자 중 80세 이상이 53.7%를 차지하고 있어, 추가적인 접종을 통한 중증·사망 예방 필요성이 커지고 있다.
- 또한, 이스라엘의 코로나19 백신 효과 연구에서, 3차접종(화이자) 후 오미크론 변이에 대한 백신 효과가 7개월 동안 지속되었고, 3차접종 대비 4차접종의 중증질환 발병이 3배 감소한 것을 확인하였다.
4-2. 2022년 인플루엔자는 과연 유행할까요?
- 질병관리청은 코로나19 재유행이 안정화되어가는 가운데 지난 2년간 유행하지 않았던 계절 인플루엔자가 오는 가을 또는 겨울철 유행 가능성이 점차 높아지고 있어 이에 대한 대응계획을 발표하였다. (2022-9월 브리핑)
- 코로나19 유행과 함께 인플루엔자 의사환자 발생은 20년 10주(20.3.2~3.8)에 유행기준 아래로 낮아진 이후 올해 상반기까지 지속적으로 낮은 수준을 유지하였으나, 올해 7월 이후 이례적으로 인플루엔자바이러스가 검출됨에 따라, 22-23절기 인플루엔자 유행가능성은 높을 것으로 예상되고 있다.
- 국내 인플루엔자 의사환자수는 22년 28주(7.3~)이후부터 지속 증가하여 36주에 4.7명으로 유행기준(4.9명/외래환자 1,000명)에 근접한 상황이다.
* 인플루엔자 의사환자(ILI) 분율: 표본감시 의료기관(200개)에 내원한 외래환자 1,000명당 인플루엔자 의사환자 수
* 최근 인플루엔자 관련 지표 추이(22년 28주-36주)
인플루엔자 의사환자 분율: 2.9명(28주) → 3.3명(32주) → 4.3명(35주) → 4.7명(36주)
인플루엔자바이러스 검출률: 2.8%(28주) → 3.9%(32주) → 4.2%(35주) → 1.9%(36주) - 코로나19 유행이 지속되며 과거 2개 절기의 경우 인플루엔자 유행 없이 지나갔으나, 22년 2분기 이후 사회적 거리두기 완화에 따른 이동량 증가, 과거 2개 절기 인플루엔자가 유행하지 않음에 따른 인구 집단 내 자연면역 감소에 따라 올해는 유행 가능성이 높을 것으로 예상된다. (남반구 지역 호주에서 겨울철 유행이 확인)
5. 항바이러스제는 코로나바이러스 어떤 부분과 과정에 작용해서 효과를 나타내는지?
바이러스는 사람 세포 속 유전물질에 관여하는 효소와 세포소기관을 이용해 증식한다. 바이러스의 메신저리보핵산(RNA)이 세포 속에 배출되면 단백질로 번역되면서 단백질 덩어리가 처음 만들어진다. 이 덩어리가 주요 프로테아제 같은 단백질 분해 효소에 의해 쪼개져야 단백질이 바이러스를 복제하는 능력을 갖추게 된다.
팍스로비드는 이 효소를 억제함으로써 바이러스가 복제되는 것을 막는다. 팍스로비드는 HIV나 C형 간염 등을 치료하는 프로테아제 억제제로, 단백질 분해효소를 억제하는 원리다. 이 효소가 억제되면 바이러스 증폭을 억제시킬 수 있다는 점에서 팍스로비드는 감염 발생 3~5일 이내에 치료를 시작해야 효과를 입증할 수 있다.
다시 말하자면, 팍스로비드는 코로나19 바이러스(SARS-CoV-2)가 세포 내에서 증식할 때 필요한 핵심 효소인 '주요 프로테아제(Mpro)' 중 하나인 3C 유사(3CL) 프로테아제를 차단하도록 설계됐다. 주요 프로테아제는 바이러스 복제에 필요한 단백질을 만드는 데 필요한 프로테아제를 뜻한다.

그림 3. Paxlovid의 작용기전
6. 롱코비드 등 코로나 관련 후유증은 왜 나타나는지?
네이처 메디슨에 발표된 ‘포스트 코로나 증후군(Post-acute COVID-19 syndrome)’논문에 따르면 코로나19 감염 이후 다양한 증상이 나타날 수 있으며 대표적으로는 피로감, 호흡곤란, 수면장애, 이명, 발열, 기침, 두통, 발진, 브레인포그(인지 장애), 어지러움, 심장 두근거림 등이 관찰된다.

그림 4. 롱코비드는 감염이 시작된지 4주 이후 생기는 다양한 증상들을 말한다
출저: Nalbandian A, Post-acute COVID-19 syndrome. Nat Med. 2021 Apr;27(4):601-615.
아래는 롱코비드의 발생원인과 관련된 최근을 연구들을 소개하고자 한다.
연구에 따르면 코로나19에 감염된 사람 중 약 10~30%에서 장기적인 후유증이 관찰될 수 있으며, 구체적인 원인은 밝혀지진 않았지만, 다음의 4가지 요인이 롱코비드의 위험성을 증가시키는 것으로 나타났다. 구체적으로는 ▲ 감염 초기 높은 수준의 바이러스 RNA ▲ 특정 자가항체 보유(the presence of certain autoantibodies) ▲ EBV(헤르페스 바이러스에 속하는 DNA바이러스)의 재활성화(the reactivation of Epstein-Bar virus) ▲ 제2형 당뇨병(having Type 2 diabetes) 등이다.
Post-acute COVID-19 syndrome. Nalbandian A, Nat Med. 2021 Apr;27(4):601-615.
롱코비드의 대표적인 증상으로는 피로증후군과 브레인포그, 호흡곤란이 있다. 특히 피로증후군은 가장 흔하게 호소하는 증상으로, 휴식을 취해도 회복되지 않는 심한 피로, 운동 후 권태감, 브레인포그 등을 유발하는 복합적인 다기관 장애이자, 바이러스 감염 후 나타나기 쉬운 증상이다. 학계에서는 과거에 바이러스후피로증후군(Post-Viral Fatigue Syndrome)이라고 명명하였던 피로증후군(Chronic Fatigue Syndrome)과 롱코비드의 증상이 매우 유사함에 근거하여, 피로증후군(CFS)의 원인으로 바이러스 감염설을 다시금 주목하고 있다.
신종 코로나바이러스 감염증에 감염된 뒤 장기적으로 후유증을 겪는 롱코비드 환자들에게서 새로운 혈액 이상 증상이 발견됐다는 연구결과가 나왔다. 연구팀은 미국의 롱코비드 환자 99명을 대상으로 혈액검사를 실시했다. 그 결과 코르티솔 호르몬의 수치가 정상 수치의 절반 수준으로 떨어진 것으로 나타났다. 참가자들의 혈액에선 병원균이 지속적으로 존재하고 있음을 의미하는 바이오마커가 나타났다. 특히 면역세포인 T세포에서는 이들의 면역체계가 병원체와 싸우고 있다는 흔적이 발견됐다.
The immunology and immunopathology of COVID-19. Merad M, Science. 2022 Mar 11;375(6585):1122-1127.
최근 미국 국립보건원(NIH) 홈페이지에 따르면 소규모 연구를 진행한 결과, 코로나19로 인해 유발된 면역반응이 어떻게 뇌를 손상할 수 있는지 확인됐다. 부검 결과, 코로나19 바이러스가 직접 뇌를 공격한 것이 아니라 항체가 뇌혈관을 둘러싸고 있는 혈뇌장벽(BBB) 세포를 공격해 염증과 조직에 손상을 일으킨 것으로 나타났다. BBB가 손상되면 단백질 누출, 출혈 또는 혈전이 발생해 뇌졸중 발생 위험이 커진다. 연구팀은 이 과정에서 면역세포의 일종인 대식세포가 손상 부위에 발생해 염증을 일으킬 수 있다고 설명했다. 국제학술지 ‘뇌(Brain)’ ‘뉴잉글랜드 저널 오브 메디슨(NEJM)’에는 코로나19 감염에 따른 두통, 피로감 등 신경학적 증상이 뇌조직 자체의 바이러스 감염이 아닌 신체의 광범위한 염증 반응에 따른 혈관 손상에 기인한 것으로 보인다는 연구결과가 실렸다.
Microvascular Injury in the Brains of Patients with Covid-19. Lee MH, N Engl J Med. 2021 Feb 4;384(5):481-483.
Lee M-H, et al. Neurovascular injury with complement activation and inflammation in COVID-19. Brain. 2022.
미국 워싱턴대 의대 연구팀은 미 퇴역군인들과 일반인의 1년간 의료기록을 분석한 결과 코로나19에 감염 이력이 있는 그룹이 그렇지 않은 그룹보다 뇌와 신경 장애를 겪는 사례가 7% 더 많다는 사실을 알아냈다고 국제 학술지 네이처 메디신에 공개했다. 연구팀은 또 같은 기간 코로나19에 감염되지 않은 563만8795명 환자 기록과 코로나 사태가 미국에서 벌어지기 직전의 또 다른 585만9621명의 기록과도 비교했다. 조사 결과 코로나19에 한번이라도 감염된 그룹은 허혈성 뇌졸중과 인지 기억 장애, 말초 신경계 장애, 편두통과 발작을 포함한 신경학적 후유증 발생 위험이 눈에 띌 만큼 증가했다.
Long-term neurologic outcomes of COVID-19. Evan Xu, Nat Med. 2022 Sep 22. Online ahead of print.
지난 3월 과학학술지 ‘셀’에 발표되었던 미 뉴욕대-컬럼비아대 공동 연구 논문에 따르면 코로나에 의해 후각, 미각 장애가 나타날 확률은 5~30%에 달한다. 이 중 10% 정도는 6개월 넘게 장기간 후각, 미각 장애를 경험하는 것으로 나타났다.
일부 연구진은 "후각 장애가 영구 장애로 남을 수 있으나 이를 진단하기 위해서는 최소 1~2년의 시간이 필요하다"라며 코로나 후유증 각각의 증상에 대응하는 게 최선이라는 입장을 보이기도 한다.
Non-cell-autonomous disruption of nuclear architecture as a potential cause of COVID-19-induced anosmia. Marianna Zazhytska, Cell. 2022 Mar 17;185(6):1052-1064.





